Aumento Digestibilidad del Ganado con Fluido Rumial
Según se exponen en bastantes estudios, el uso de fluido rumial de un rumiante sano a un ejemplar enfermo (en este caso entre vacas) parece una técnica bastante habitual. Es una técnica bastante utilizada para recuperar el microbioma (microbiota) de la zona en donde se produce la mayor digestibilidad, que en realidad producida por esta colonias bacterianas. Es decir, en la zona de los estómagos de los rumiantes y parte inicial del intestino. Al perder esa pacacidad digestiva del microbioma a los animales les empieza a sentar mal los alimentos, pierden peso y es un riegso para su vida. Si bien es una técnica utilizada desde hace bastante tiempo, provocando el vómito del animal. En la actualidad, para mayor rapidez y facilidad se practica un orificio en el vientre de la vaca para tener acceso directo al interior de uno de sus estómago, como se puede observar en la siguiente imagen:
 Extracción del Rumen por acceso externo / Escuela de Medicina Veterinaria, Universidad de California, USA.
Extracción del Rumen por acceso externo / Escuela de Medicina Veterinaria, Universidad de California, USA.
¿Por qué o a qué se debe esta práctica? Parece ser que debido a la gran toma de antibióticos a las que se ve sometido el ganado le produce una pérdida del microbioma de dicha zona, provocan la pérdida de la capacidad de digerir alimentos y, por tanto, una merma en la salud y peso del animal, pudiendo llegar a un estado muy grave. Para evitar esto, esta técnica llamada Transfaunación en la jerga ganadera, es una técnica de recuperación de la salud de los animales, pareciendo ser una técnica fácil, rápida y efectiva según exponen los estudios. También esta circunstancia se puede dar por cirugías practicadas a los animales.
En algunos estudios, además, hacen test de microbioma específicos al ganado para mostrar los cambios producidos antes y después de la toma de antibióticos:
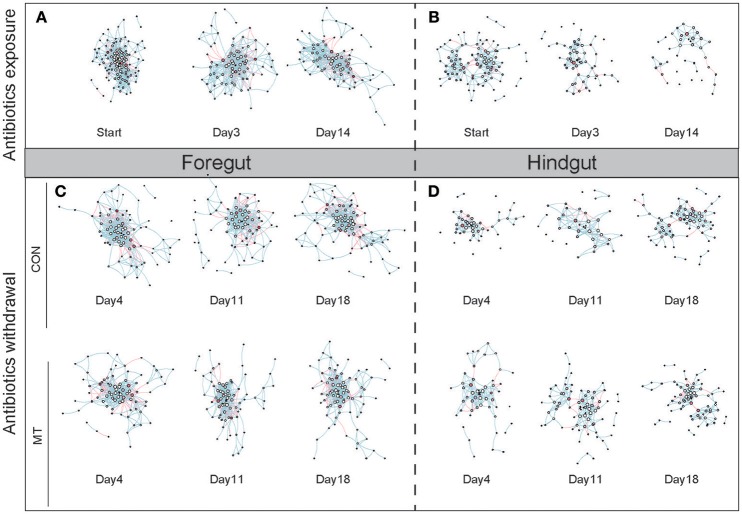 "Figura 7: La red de co-ocurrencia cambia en el intestino anterior y posterior después de la exposición a los antibióticos y la retirada de los mismos. (A) La red de co-ocurrencia cambia en el intestino anterior después de la exposición a antibióticos. (B) La red de co-ocurrencia cambia en el intestino grueso después de la exposición a antibióticos. (C) El cambio de la red de co-ocurrencia en el intestino anterior después de la abstinencia de antibióticos. (D) El cambio de la red de co-ocurrencia en el intestino grueso después de la abstinencia de antibióticos. Los nodos representaban OTU de alta confianza en cada subconjunto de datos, el tamaño de cada nodo representaba el valor del grado del nodo, el color de cada nodo representaba el valor de vulnerabilidad del nodo. El borde representa una correlación significativa entre dos nodos ( P<0,001), el color del borde representaba una correlación negativa (rojo) o positiva (azul) de dos nodos conectados."
"Figura 7: La red de co-ocurrencia cambia en el intestino anterior y posterior después de la exposición a los antibióticos y la retirada de los mismos. (A) La red de co-ocurrencia cambia en el intestino anterior después de la exposición a antibióticos. (B) La red de co-ocurrencia cambia en el intestino grueso después de la exposición a antibióticos. (C) El cambio de la red de co-ocurrencia en el intestino anterior después de la abstinencia de antibióticos. (D) El cambio de la red de co-ocurrencia en el intestino grueso después de la abstinencia de antibióticos. Los nodos representaban OTU de alta confianza en cada subconjunto de datos, el tamaño de cada nodo representaba el valor del grado del nodo, el color de cada nodo representaba el valor de vulnerabilidad del nodo. El borde representa una correlación significativa entre dos nodos ( P<0,001), el color del borde representaba una correlación negativa (rojo) o positiva (azul) de dos nodos conectados."
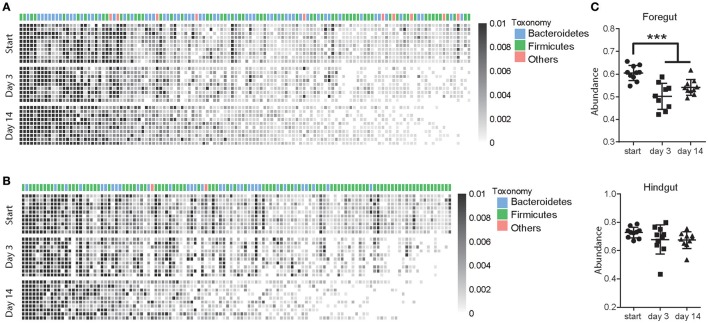 "Figura 4: Los antibióticos alteraron las OTU de alta confianza en el intestino anterior y posterior. (A, B) Las OTU de alta confianza cambian en el intestino anterior (A) y el intestino posterior (B) después del uso de antibióticos. Cada columna representaba una OTU y cada fila representaba una vaca individual desde el período de pretratamiento (Inicio) hasta 3 y 14 días después de la exposición a los antibióticos, la asignación taxonómica se indica en la parte superior de cada columna. (C) La abundancia total de OTU de alta confianza cambia en el intestino anterior y posterior después de la exposición a los antibióticos. Los datos se expresan como media ± de *** P <0,01."
"Figura 4: Los antibióticos alteraron las OTU de alta confianza en el intestino anterior y posterior. (A, B) Las OTU de alta confianza cambian en el intestino anterior (A) y el intestino posterior (B) después del uso de antibióticos. Cada columna representaba una OTU y cada fila representaba una vaca individual desde el período de pretratamiento (Inicio) hasta 3 y 14 días después de la exposición a los antibióticos, la asignación taxonómica se indica en la parte superior de cada columna. (C) La abundancia total de OTU de alta confianza cambia en el intestino anterior y posterior después de la exposición a los antibióticos. Los datos se expresan como media ± de *** P <0,01."
Y también hacen test de microbioma antes y después de la transferencia del fluido rumial:
 "Figura 7: La red de co-ocurrencia cambia en el intestino anterior y posterior después de la exposición a los antibióticos y la retirada de los mismos. (A) La red de co-ocurrencia cambia en el intestino anterior después de la exposición a antibióticos. (B) La red de co-ocurrencia cambia en el intestino grueso después de la exposición a antibióticos. (C) El cambio de la red de co-ocurrencia en el intestino anterior después de la abstinencia de antibióticos. (D) El cambio de la red de co-ocurrencia en el intestino grueso después de la abstinencia de antibióticos. Los nodos representaban OTU de alta confianza en cada subconjunto de datos, el tamaño de cada nodo representaba el valor del grado del nodo, el color de cada nodo representaba el valor de vulnerabilidad del nodo. El borde representa una correlación significativa entre dos nodos ( P<0,001), el color del borde representaba una correlación negativa (rojo) o positiva (azul) de dos nodos conectados."
"Figura 7: La red de co-ocurrencia cambia en el intestino anterior y posterior después de la exposición a los antibióticos y la retirada de los mismos. (A) La red de co-ocurrencia cambia en el intestino anterior después de la exposición a antibióticos. (B) La red de co-ocurrencia cambia en el intestino grueso después de la exposición a antibióticos. (C) El cambio de la red de co-ocurrencia en el intestino anterior después de la abstinencia de antibióticos. (D) El cambio de la red de co-ocurrencia en el intestino grueso después de la abstinencia de antibióticos. Los nodos representaban OTU de alta confianza en cada subconjunto de datos, el tamaño de cada nodo representaba el valor del grado del nodo, el color de cada nodo representaba el valor de vulnerabilidad del nodo. El borde representa una correlación significativa entre dos nodos ( P<0,001), el color del borde representaba una correlación negativa (rojo) o positiva (azul) de dos nodos conectados."
Esta técnica también se aplica en terneros que no tienen un adecuado crecimiento ni peso para su edad (bajo percentil). Así pues, se utiliza para poder asegurar un buen desarrollo y un adecuado peso en el ternero. Aunque el recabado de los datos en estos estudios es correcto, no suelen mostrar imágenes del resultado. En este caso hemos conseguido uno, que a pesar de no ser el mismo ternero, refleja un ejemplo de los resultados en la mejora de la salud del ganado:
 Animal enfermo recibe el Rumen (Receptor del fluido) / Universidad Nacional Agraria de Nicaragua
Animal enfermo recibe el Rumen (Receptor del fluido) / Universidad Nacional Agraria de Nicaragua
 Antes de la Transfaunación / Universidad Nacional Agraria de Nicaragua
Antes de la Transfaunación / Universidad Nacional Agraria de Nicaragua Después de la Transfaunación / Universidad Nacional Agraria de Nicaragua
Después de la Transfaunación / Universidad Nacional Agraria de Nicaragua
Bibliografía:
1.1- Departamento de Animales de Granja y Salud Pública Veterinaria, Clínica Universitaria para Rumiantes, Universidad de Medicina Veterinaria de Viena, Viena Austria,
1.2- The Platform Biostatistics, Departamento de Ciencias Biomédicas, Universidad de Medicina Veterinaria de Viena, Viena Austria
Autores: Simone Steiner, Nina Linhart, Anita Neidl, Walter Baumgartner, Alexander Tichy, y Thomas Wittek
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7004065/
2.1- Departamento de Ciencias Agrícolas, Alimentarias y Nutricionales, Universidad de Alberta, 416F Agr / For Center, Edmonton, Alberta T6G 2P5 Canadá
2.2- Facultad de Ciencias Animales, Universidad de Zhejiang, Hangzhou, 310058 Zhejiang China
Autores: Mi Zhou, Yong-Jia Peng, Yanhong Chen, Christen M. Klinger, Masahito Oba, Jian-Xin Liu y Le Luo Guan
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5869788/
3.1- Laboratorio Estatal de Nutrición Animal, Centro de Investigación de Tecnología de Ingeniería de Beijing para el Control de Calidad y Seguridad de la Leche Cruda, Facultad de Ciencia y Tecnología Animal, Universidad Agrícola de China, Beijing, China
3.2- Laboratorio de Nutrición Animal, Facultad de Ciencias Animales, Universidad de Tarim, Alar, China
3.3- Laboratorio de Nutrición Animal, Facultad de Ciencia y Tecnología Animal, Universidad Shihezi, Shihezi, China
Editado por: Saleh A. Naser, Universidad de Florida Central, Estados Unidos
Revisado por: Valerio Iebba, Sapienza Università di Roma, Italia; Mohtashem Samsam, Facultad de Medicina de la Universidad de Florida Central, Estados Unidos
Autores: Shoukun Ji, Tao Jiang, Hui Yan, Chunyan Guo, Jingjing Liu, Huawei Su, Gibson M. Alugongo, Haitao Shi, Yajing Wang, Zhijun Cao, y Shengli Li
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5859144/
4.1- UNIVERSIDAD NACIONAL AGRARIA (UNA), FACULTAD DE CIENCIA ANIMAL (FACA), DEPARTAMENTO DE VETERINARIA, Ciencia Producción Y Protección Animal
Autores: Elvis Perez Matute y Rodiel Sirias Chavarria
https://repositorio.una.edu.ni/1395/